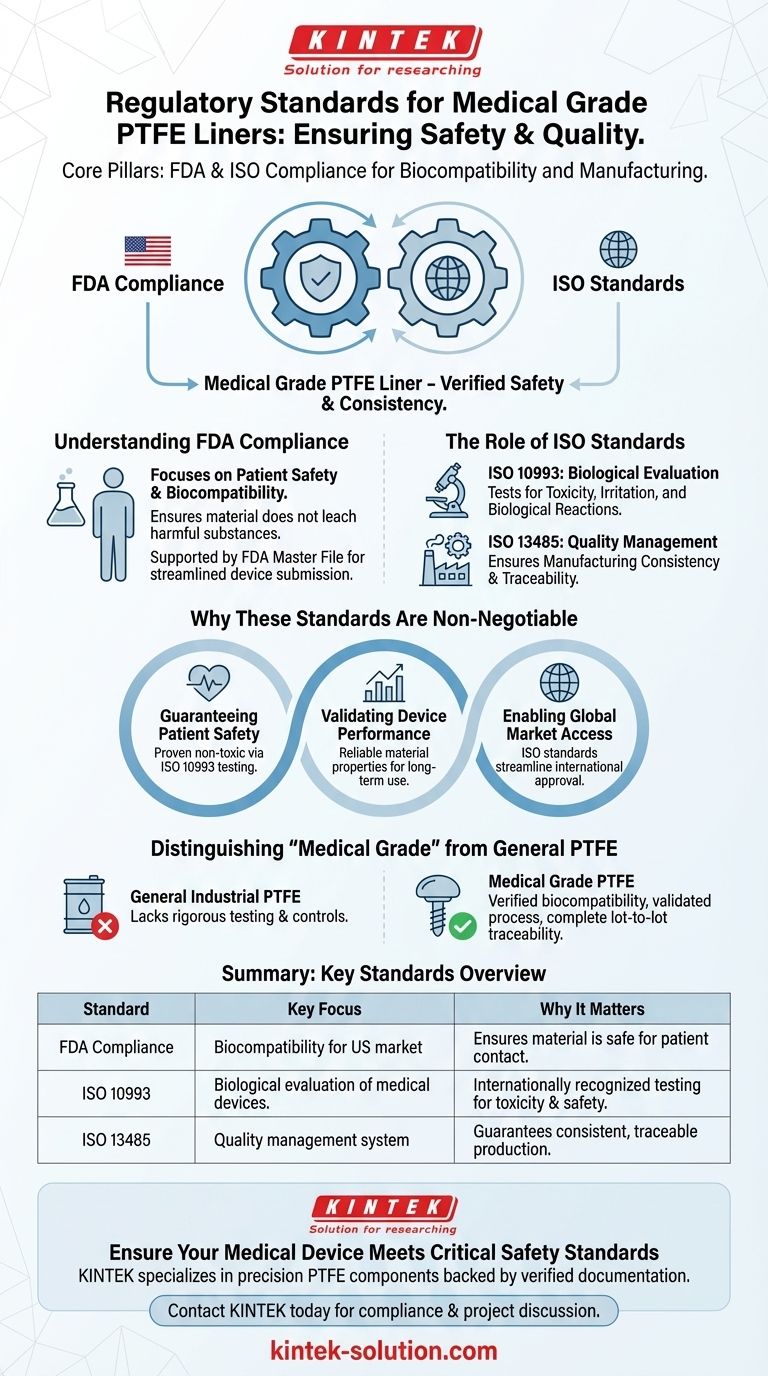
本質的に、医療グレードのポリテトラフルオロエチレン(PTFE)ライナーは、米国食品医薬品局(FDA)と国際標準化機構(ISO)という2つの主要機関によって設定された厳格な基準を満たす必要があります。これらの認証は任意ではなく、材料が安全で信頼性が高く、重要な医療機器用途に適していることを保証するための基本的な要件です。コンプライアンスは、材料の生体適合性と製造プロセスの均一性を裏付けます。
重要な点は、「医療グレード」は単なるマーケティング用語ではないということです。これは、主に生体適合性に関するISO 10993への準拠と、医療用途を意図した材料に関するFDA規制の遵守によって定義される、検証済みの安全と品質のレベルを意味します。

主要な規制の柱:FDAとISO
医療グレードのライナーの価値を理解するには、これらの2つの規格が提供する保護を理解する必要があります。これらは連携して、材料の安全性と製造品質の両方を保証します。
FDAコンプライアンスの理解
FDAは、患者の安全を確保するために医療機器に使用される材料を規制しています。PTFEライナーの場合、これは材料が生体適合性があり、有害物質を溶出しないと見なされることを意味します。
FDAコンプライアンスは、マスターファイルによってサポートされることが多く、これにより製造業者は、顧客のデバイス提出をサポートするための審査のために、材料に関する機密データを当局に直接提出できます。
ISO規格の役割
ISO規格は、品質と安全性のための国際的な枠組みを提供します。PTFEのような医療材料にとって最も重要な規格は、医療機器の生物学的評価に関するISO 10993です。
この規格は、材料が人体との接触時に毒性、刺激性、その他の害などの有害な生物学的反応を引き起こさないことを確認するためのテストシリーズを概説しています。
製造の一貫性の確保
材料そのものに加えて、ISO 13485などの規格は、医療機器製造のための品質マネジメントシステムの要件を規定しています。
この規格に準拠しているサプライヤーは、テストおよび承認されたライナーと全く同じ品質、純度、トレーサビリティをもってすべてのライナーが製造されることを保証するための堅牢なプロセスを確立していることを示します。
なぜこれらの規格は譲れないのか
コンプライアンスは医療機器開発の基盤です。それは患者の転帰、デバイスの性能、そして製品を市場に投入する能力に直接影響します。
患者の安全の保証
これらの規制の主な機能は患者を保護することです。ISO 10993に従った生体適合性試験は、PTFEライナーが意図された用途に対して無毒で安全であることを証明する最も直接的な方法です。
デバイスの性能と寿命の検証
PTFEの固有の特性—耐久性、化学的不活性性、低い吸水性など—は、長期的な医療用途に理想的です。規制遵守は、これらの材料特性がバッチごとに一貫して存在し、信頼できることを保証し、デバイスがそのライフサイクル全体を通じて設計どおりに機能することを保証します。
グローバル市場アクセスの実現
FDAは米国市場を規制していますが、ISOは世界的に認められている標準です。ISO 10993およびISO 13485への準拠は、ヨーロッパ、アジアなど、多くの国での規制承認プロセスを合理化します。
「医療グレード」と一般PTFEの区別
一般的なPTFEが医療用途に適していると想定することは、よくある落とし穴です。汎用PTFEと医療グレードPTFEの区別は極めて重要であり、重大な規制上の意味合いを持ちます。
化学だけでなく、管理が重要
標準的な工業用PTFEは、一部の一般的な仕様(例:食品接触用)を満たすかもしれませんが、医療用途に必要な厳格な試験と製造管理を欠いています。
「医療グレード」とは、材料が特定の生体適合性試験に合格し、検証され、管理され、追跡可能なプロセス下で製造されたことを意味します。
トレーサビリティの極めて重要な重要性
医療グレードのコンポーネントには、原材料のポリマー樹脂から最終的なパッケージ化されたライナーに至るまで、ロットごとの完全なトレーサビリティが必要です。
これにより、問題が発生した場合でも、影響を受けたバッチを迅速かつ正確に特定でき、これはあらゆる医療品質システムの核となる要件です。
サプライヤーに要求すべきこと
常にISO 10993へのコンプライアンスを明示的に記載した文書を要求してください。「業界標準を満たしている」といった曖昧な主張は受け入れないでください。
さらに、サプライヤーがISO 13485などの認証された品質マネジメントシステムの下で運営されていることを確認し、プロセス管理と一貫性を保証してください。
特定の用途でのコンプライアンスを確認する方法
適切な材料を選択するには、適切な証明を求める必要があります。お客様の特定の目標によって、どの文書が最も重要になるかが決まります。
- 患者の安全と生体適合性が主な焦点の場合: ライナーに関するISO 10993試験を具体的に参照するコンプライアンス証明書を要求してください。
- 一貫した製造と品質管理が主な焦点の場合: サプライヤーがISO 13485または同等の医療機器品質マネジメントシステムによって認証されていることを確認してください。
- 米国市場での承認が主な焦点の場合: デバイス提出プロセスを簡素化するために、材料がFDAマスターファイルによってサポートされていることを確認してください。
結局のところ、検証済みのコンプライアンスを持つライナーを選択することは、リスクを軽減し、医療機器の成功を確実にするための基礎的なステップです。
要約表:
| 規格 | 主な焦点 | 重要性 |
|---|---|---|
| FDAコンプライアンス | 米国市場向けの生体適合性 | 材料が患者との接触に安全であり、有害物質を溶出しないことを保証します。 |
| ISO 10993 | 医療機器の生物学的評価 | 毒性、刺激性、安全性に関する国際的に認められた試験。 |
| ISO 13485 | 製造のための品質マネジメントシステム | すべてのライナーの一貫した、追跡可能な、高品質な製造を保証します。 |
重要な安全基準を満たしていることを医療機器で確認する
PTFEコンポーネントに関するFDAおよびISOコンプライアンスのナビゲートは複雑ですが、一人で行う必要はありません。KINTEKは、医療、半導体、実験室業界の厳しい要求を満たす精密PTFEシール、ライナー、ラボウェアの製造を専門としています。
当社は、デバイス承認プロセスを合理化するために必要な、検証済みの文書と材料トレーサビリティを提供します。プロトタイプから大量生産まで、当社のカスタムファブリケーションは品質と安全性へのコミットメントに裏打ちされています。
コンプライアンスにおける信頼できるパートナーになりましょう。 KINTEKに今すぐお問い合わせいただき、プロジェクトの要件についてご相談の上、コンポーネントが最高水準で構築されていることを確認してください。
ビジュアルガイド
関連製品
- テフロン容器およびコンポーネントのためのカスタムPTFE部品メーカー
- テフロン部品とPTFEピンセットのためのカスタムPTFE部品メーカー
- 先端科学・産業用途向けカスタムPTFE測定シリンダー
- 高度な用途向けのカスタムPTFEスリーブおよびホローロッド
- 多様な産業用途向けカスタムPTFEボトル